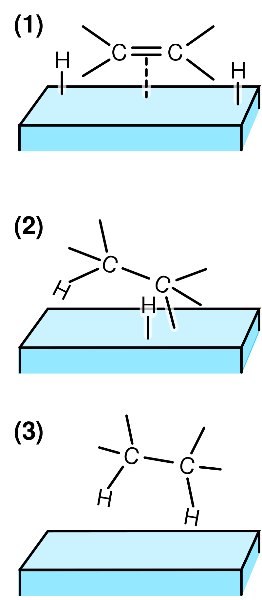
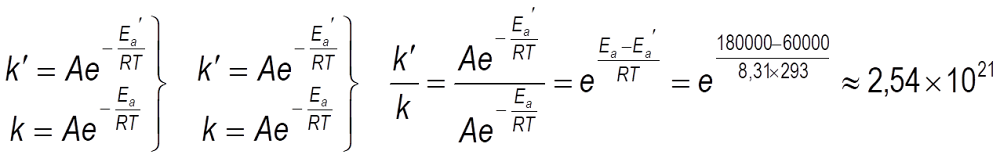Un catalizador es una sustancia que, sin ser un reactivo ni un producto, aumenta la velocidad de la reacción por su sola presencia. Por ejemplo, las reacciones de hidrogenación de los alquenos requieren un catalizador metálico de platino o de paladio.
Los catalizadores en realidad sí intervienen en el mecanismo de reacción: se unen a los reactivos, facilitan su conversión en productos y se separan de los productos; pero como se regeneran tras la catálisis y no se consumen, parece que no intervienen.
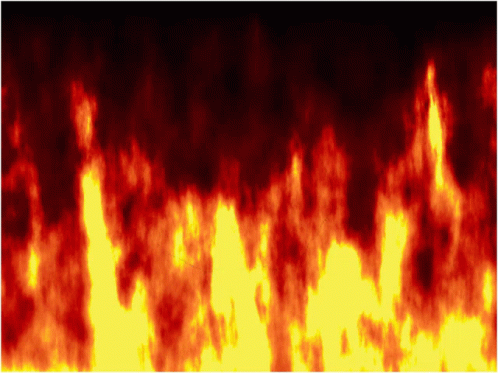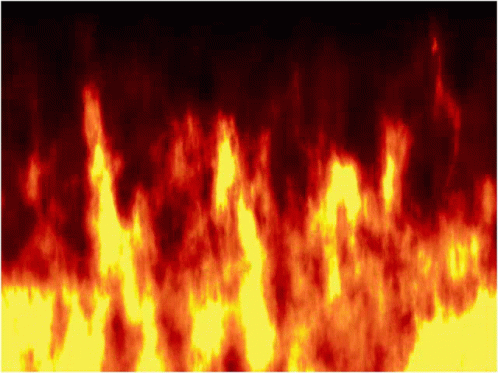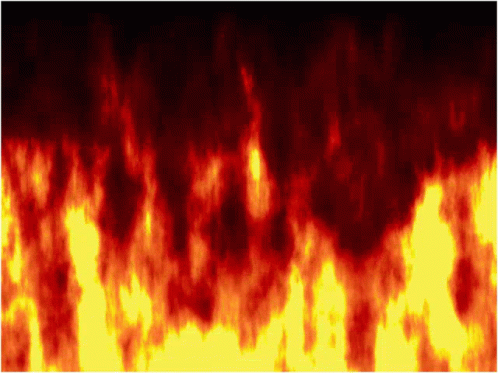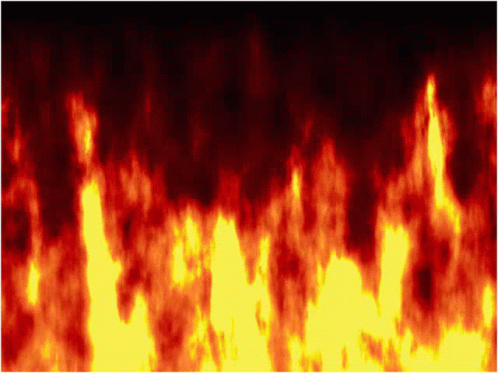
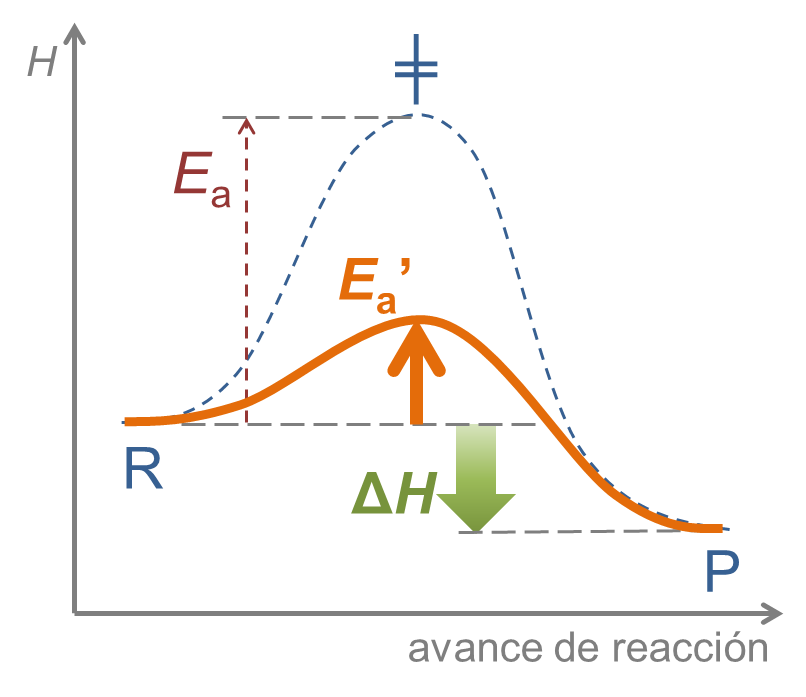 ¿Cómo funciona un catalizador? Lo que hace es proporcionar un mecanismo de reacción alternativo, que cursa con menor energía de activación. Al ser menor la energía de activación Ea' < Ea, las moléculas de reactivo alcanzan el estado de transión alternativo más fácilmente que sin catalizador; así que el número de moléculas por unidad de tiempo que superan la energía de activación con catalizador es mayor que sin catalizador, y por eso se transforman más moléculas en producto, y la velocidad de reacción es mayor.
¿Cómo funciona un catalizador? Lo que hace es proporcionar un mecanismo de reacción alternativo, que cursa con menor energía de activación. Al ser menor la energía de activación Ea' < Ea, las moléculas de reactivo alcanzan el estado de transión alternativo más fácilmente que sin catalizador; así que el número de moléculas por unidad de tiempo que superan la energía de activación con catalizador es mayor que sin catalizador, y por eso se transforman más moléculas en producto, y la velocidad de reacción es mayor.
Por ejemplo, las enzimas son proteínas que presentan una cavidad que se complementa fisicoquímicamente con las moléculas de reactico y con el estado de transición. Ejercen con las moléculas de los reactivos y de los interemedios un efecto estabilizador similar al de las moléculas de agua cuando solvatan los iones de una sal en disolución. De esta manera, consiguen acelerar las reacciones orgánicas en cientos de miles de veces, sin necesidad de aumentar la temperatura de los reactivos.