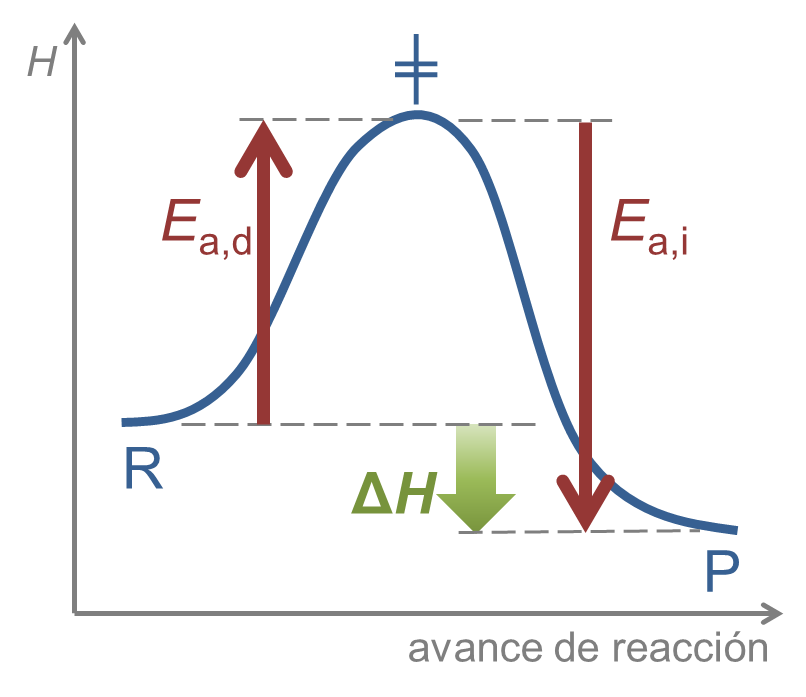
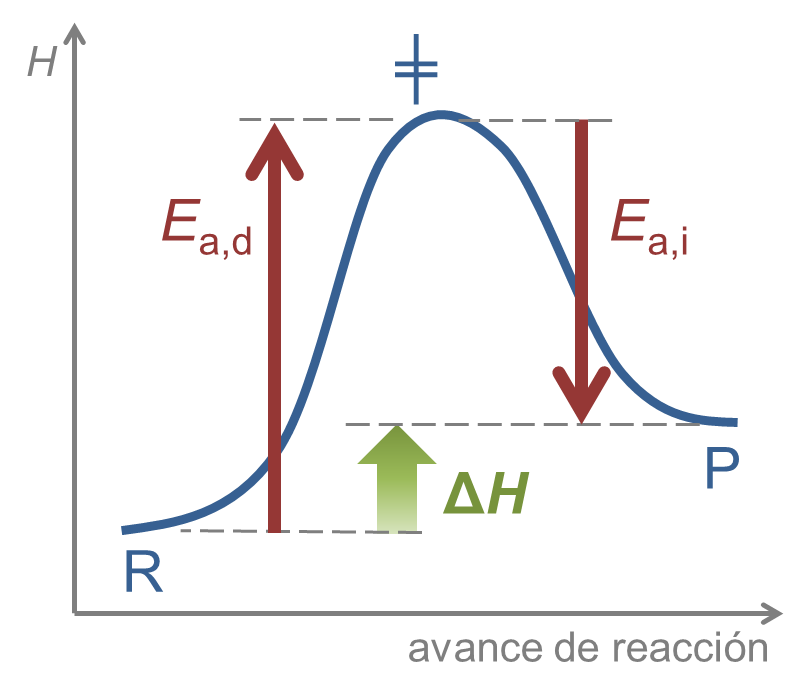
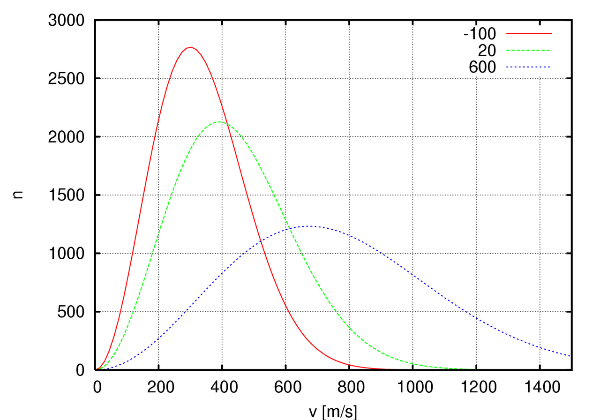
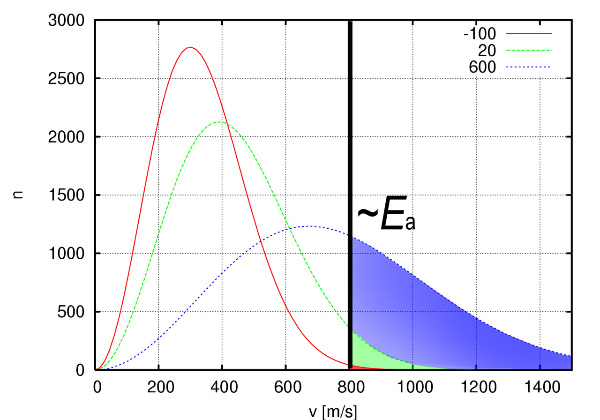
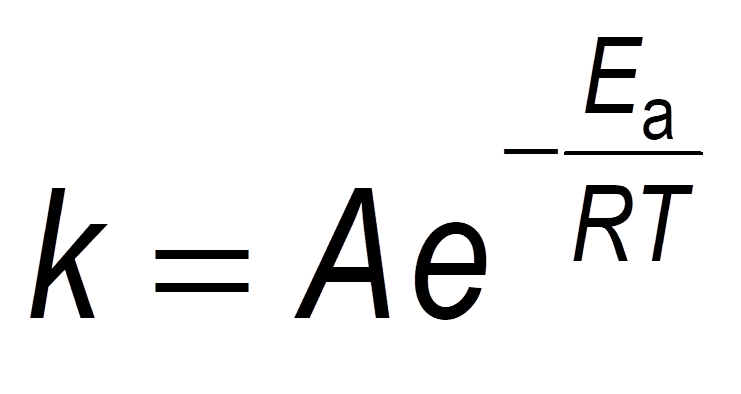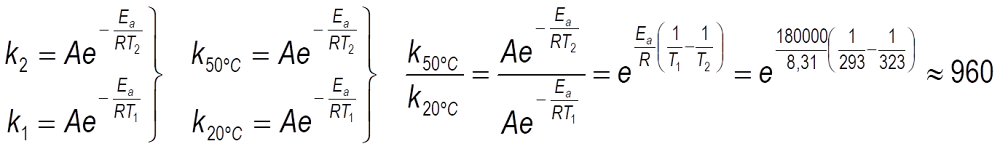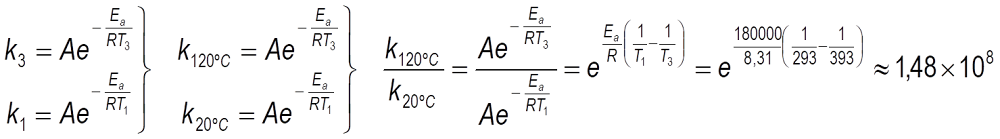La velocidad de reacción es el resultado de un compromiso entre dos tendencias:
- la energía cinética de agitación térmica, que favorece la reacción, y
- la energía de activación, que se puede considerar una resistencia de la reacción a suceder (ya que cuando mayor sea Ea, menos será la v a una T dada).
Arrhenius derivó la siguiente expresión para describir la dependencia de la v con la T:
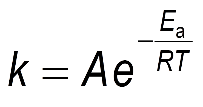 Nótese que cuando más baja la T, mayor es el cociente del exponente, pero negativo, y entonces k tiende a 0 (porque las moléculas no tienen Ec suficiente para dar lugar a los productos). Y cuanto más alta la T, menor es el cociente, y k tiende a A (porque las moléculas tienen Ec suficiente para reaccionar). Cuando más alta sea Ea, mayor tiene que ser la T para que k alcance un valor alto (porque la Ec mínima necesaria para reaccionar es grande), y si la Ea es pequeña, la T necesaria para reaccionar no es alta (se supera fácilmente).
Nótese que cuando más baja la T, mayor es el cociente del exponente, pero negativo, y entonces k tiende a 0 (porque las moléculas no tienen Ec suficiente para dar lugar a los productos). Y cuanto más alta la T, menor es el cociente, y k tiende a A (porque las moléculas tienen Ec suficiente para reaccionar). Cuando más alta sea Ea, mayor tiene que ser la T para que k alcance un valor alto (porque la Ec mínima necesaria para reaccionar es grande), y si la Ea es pequeña, la T necesaria para reaccionar no es alta (se supera fácilmente).